盘点精要 | 三代EGFR-TKI耐药机制及应对策略
近年来,以表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)为代表的靶向治疗给晚期肺癌患者提供了一线生机。EGFR‐TKIs通过明确靶向EGFR中的激活突变,显著提高了肺癌的治疗效果,延长了肺癌患者的生存时间。以奥希替尼为代表的三代EGFR-TKI,因其良好的治疗效果、低毒性、高入脑率,目前已作为非小细胞肺癌EGFR突变患者一线治疗或获得性T790M耐药突变后二线治疗的首选,但依然还是不可避免的出现耐药,而且三代药物的耐药机制更加混乱复杂,这导致三代药物耐药后的治疗陷入瓶颈,因此,目前迫切需要新的治疗策略来打破这一僵局[1]。

TKI初治EGFR突变型肿瘤的耐药类型
肿瘤的发生发展及耐药的机制复杂,涉及多条通路信号的复杂协作,EGFR通路也不例外。那么三代EGFR-TKIs出现耐药之后又该如何着手呢,首先需明确耐药的分子机制,迄今为止,已经确定了几种三代EGFR-TKIs的主要耐药机制,分别为EGFR依赖性耐药,如EGFR突变、扩增和缺失;EGFR非依赖性耐药,如MET扩增、HER2扩增、BRAF和KRAS突变等及表型或组织学转化。
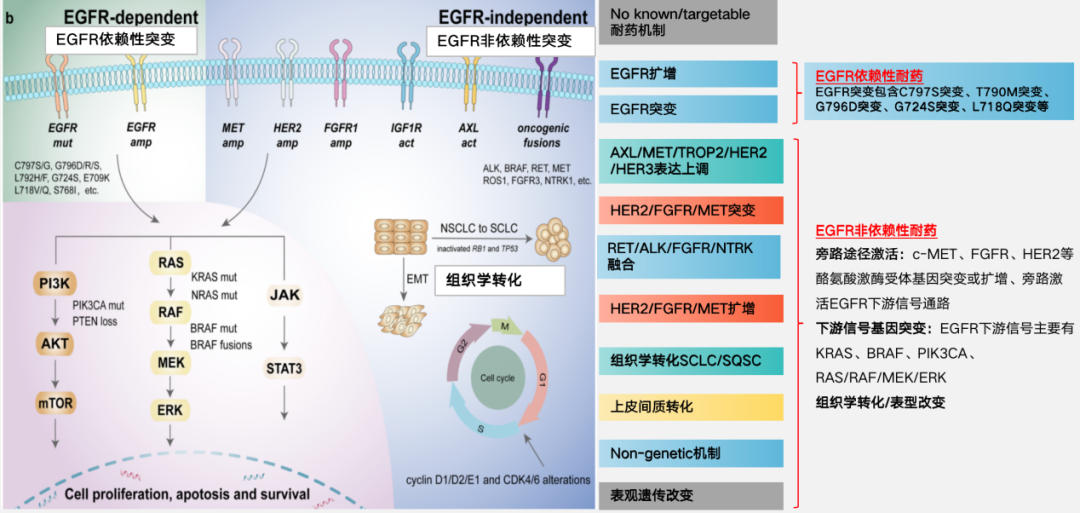
三代EGFR-TKI耐药机制[2]
EGFR通路依赖性耐药:C797S耐药突变
EGFR依赖性耐药为EGFR基因或蛋白本身发生改变,使EGFR-TKIs无法靶向杀伤肿瘤细胞。20号外显子上C797S突变是经奥希替尼治疗后EGFR依赖型耐药的重要机制。
C797S突变导致三代EGFR-TKI耐药原因探索:
C797S突变导致非小细胞肺癌对奥希替尼耐药的原因可能是由于奥希替尼主要通过与EGFR的ATP结合域中的第797位的半胱氨酸形成共价键,形成空间位阻,阻止了EGFR的激活,从而达到治疗癌症的目的。然而C797S位于EGFR的酪氨酸激酶区,突变使其无法在ATP结合域内继续形成共价键,从而失去抑制EGFR激活的效果,导致耐药的发生[3]。
奥希替尼一线和二线的使用所引起的C797S突变有所不同。奥希替尼在一线使用时,由于直接抑制了T790M,耐药后只会出现C797S的单突变(不伴有T790M);在后线用(1/2代耐药后出现T790M突变时),耐药后多出现C797S的共突变(与T790M同时出现),又分为顺式(cis)和反式(trans)两种结构。所谓顺式,通常是指一条正常的染色体上先后EGFR T790M突变以及C797S突变。而反式,通常是指一条正常的染色体上EGFR T790M突变,随后在配对的另一条染色体上出现C797S突变。

EGFR T790M C797S顺反式等位基因关系[4]
所以C797S突变引起的耐药需要根据突变类型来选择应对策略,接下来,我们分享三种突变方式的临床治疗策略。
1
C797S单突变:一代TKI治疗可逆转耐药
奥希替尼一线治疗后发生的“单纯C797S突变”,该位点作为不可逆EGFR-TKI共价结合位点,突变会影响不可逆EGFR-TKI与对应蛋白区域结合,因此吉非替尼等第一代EGFR-TKI对其仍有抑制作用[3]。
2
反式C797S/T790M突变 : 奥希替尼联合
一代EGFR-TKI
携带EGFR T790M/C797S反式突变的比例其实很低,四分之一或者更低。对目前获批的 EGFR-TKIs 单药或联合治疗均耐药,可以采用一代联合三代EGFR-TKIs进行治疗。
2019年,陆舜教授团队在JTO杂志上发表反式突变的国内个案[5],一例42岁女性肺腺癌19Del患者在多线耐药后(厄洛替尼、化疗),T790M阳性用奥希替尼治疗。3年后耐药出现C797S及T790M共突变,反式结构,患者后续使用厄洛替尼联合奥希替尼的联合治疗,同时加上贝伐珠单抗,维持了8个月,影像学评估肺部病灶也达到了部分缓解(PR)。
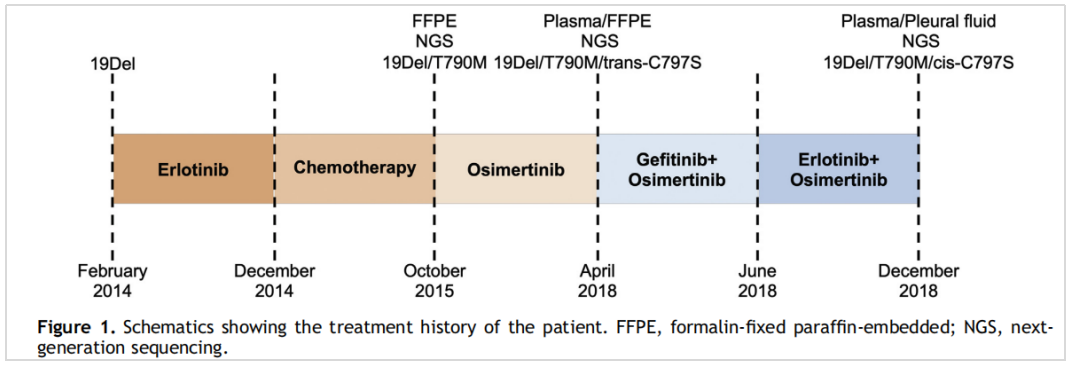
患者检测史和治疗进程
3
顺式C797S/T790M突变
治疗策略一:西妥昔单抗联合布格替尼
对于EGFR T790M/cis-C797S(顺式)突变,目前尚无成熟的EGFR-TKIs或联合用药治疗方案。
研究表明,布格替尼(AP26113)能与EGFR三重突变(19Del或L858R/T790M/C797S)蛋白结合,减少EGFR的表达。布格替尼与西妥昔单抗联用具有协同作用,能有效抑制EGFR磷酸化减少肿瘤细胞EGFR表达,并可延迟奥希替尼的获得性耐药。而且,西妥昔单抗能增强布格替尼对EGFR 19Del/T790M/C797S顺式突变的活性。
研究显示布格替尼(AP26113)联合西妥昔单抗治疗EGFR、T790M和C797S三重顺式突变的NSCLC患者显示出较好的疗效和安全性。在5例接受联合治疗的NSCLC患者中,3例患者部分缓解,2例患者病情稳定,总客观缓解率为60%,疾病控制率为100%,中位PFS为14个月;而接受顺铂双重化疗的患者的中位PFS仅为3个月[6]。

治疗策略二:四代EGFR-TKI:EAI045联合西妥昔单抗治疗
EAI045是首个第四代EGFR抑制剂,与ATP位点的结合不依赖于Cys 797,其突变不影响EAI045的疗效,因为其残基远离变构结合囊,变构抑制剂由于受体二聚作用而单独使用无效,然而,与西妥昔单抗联合应用对T790M和C797S完全有效,有望成为有效的治疗策略。但其目前的研究还处于临床前阶段,临床疗效目前尚不清楚,有待进一步实验进展才能投入试用[7]。
目前还没有标准的治疗指南来管理C797S介导的奥希替尼耐药,但是C797S在顺反式中的克隆进化揭示了肺癌的异质性和复杂性,值得进一步探究。
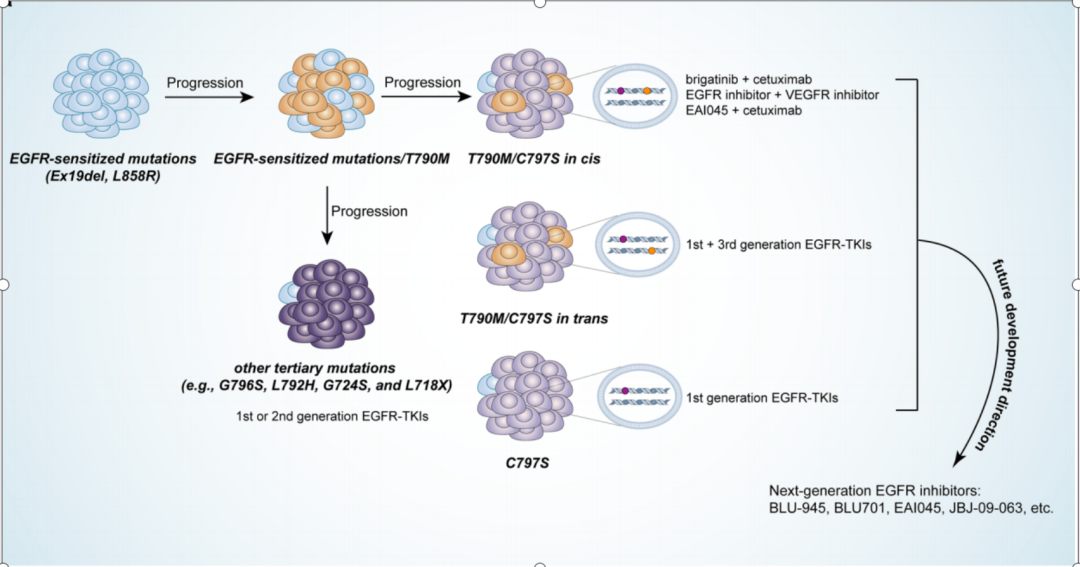
EGFR 通路依赖性耐药治疗策略[2]
EGFR非依赖性耐药
EGFR非依赖性耐药是指 EGFR 通路之外的致癌途径异常激活,从而实现逃逸,主要包括旁路途径激活c-MET、FGFR、HER2等、酪氨酸激酶受体基因突变或扩增、旁路激活EGFR下游信号通路KRAS、BRAF、MEK/ERK等。
1
MET扩增耐药治疗策略:奥希替尼+MET抑制剂
MET扩增是EGFR-TKIs最常见的非EGFR依赖性耐药机制,发生率约为5%-20%。奥希替尼联合MET-TKI是EGFR-TKI耐药后MET扩增患者的主要治疗策略[8-10]。

2
HER2扩增耐药治疗策略:奥希替尼+吡咯替尼
/T-DM1/波奇替尼
HER2扩增在三代EGFR-TKI治疗耐药中的发生率约为2%(FLAURA研究)。在临床中,奥希替尼联合HER2靶点的TKI药物如波奇替尼、吡咯替尼及靶向HER2的抗体偶联药物T-DM1(恩美曲妥珠单抗)等均可以有效控制奥希替尼治疗后出现HER2耐药的NSCLC患者[11-13]。

3
RET融合耐药治疗策略:奥希替尼+塞普替尼
RET融合在三代EGFR-TKI治疗耐药中的发生频率约为1%。NCCN 指南推荐 RET 选择性抑制剂 塞普替尼、普拉替尼和多靶点抑制剂 cabozanitib 治疗 RET 融合的 NSCLC。一项系统分析[14]纳入了12名(其中1人无法评估)EGFR-TKI耐药NSCLC患者,患者接受80mg奥希替尼每日一次+80mg 塞普替尼每日两次治疗,结果显示奥希替尼联合RET抑制剂治疗耐药NSCLC的ORR达50%,12例患者的mDoR为7.4个月(0.6-16.7个月)。

4
BRAF变异耐药治疗策略:奥希替尼+维莫非尼
或达拉非尼+曲美替尼
BRAF变异(包括融合、突变)在三代EGFR-TKI一线治疗耐药中的发生率约为6%。2022 ASCO(摘要号:e21021)报道一项前瞻性研究:对于在奥希替尼治疗中获得BRAF V600E突变的EGFR突变患者,前瞻性地进行EGFR-BRAF联合抑制治疗疗效的探索。在5例患者中所进行的前瞻性研究显示,奥希替尼+维莫非尼(4例)或达拉非尼+曲美替尼(1例)的治疗,可以给患者带来长达7.8个月的中位PFS,在1例患者中发现了3级皮疹。
对于EGFR和BRAF共突变的NSCLC患者,后续的非靶向EGFR和BRAF的靶向治疗疗效劣于化疗。EGFR-BRAF共抑制能够提高此类患者的疗效。但样本量较小,仍需后续大样本量研究进一步证实。
目前针对EGFR非依赖性途径耐药的治疗方式还在初步研究中,但是新出现的临床证据已经证明,对于EGFR非依赖性的奥希替尼耐药,双重通路抑制显示出初步的疗效。
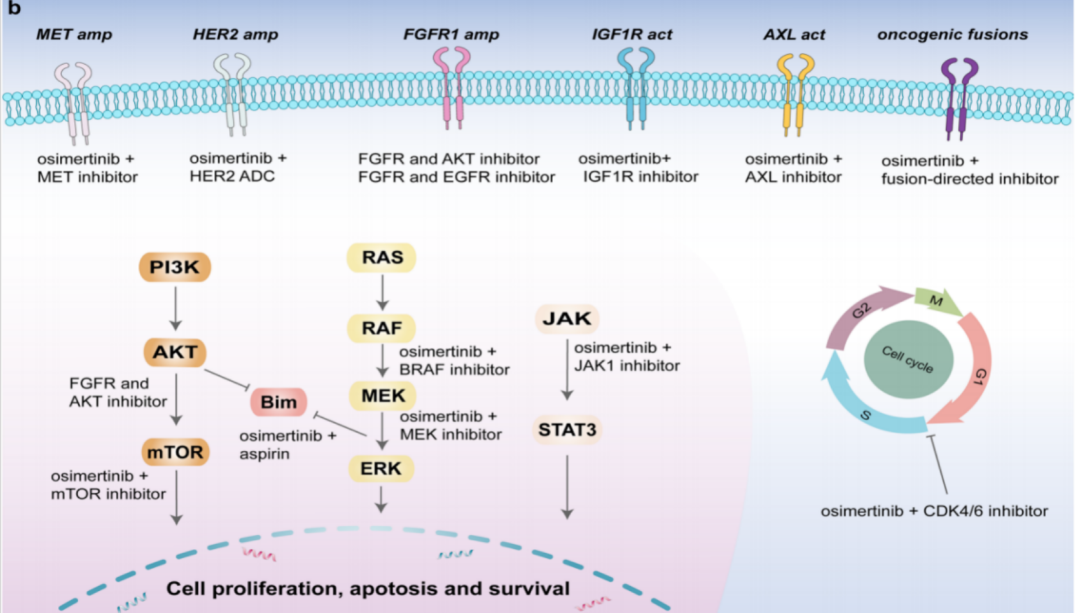
EGFR 非依赖性耐药治疗策略[2]
组织学转化
奥希替尼耐药后转化为小细胞肺癌(SCLC)的发生率为5%-15%。目前尚缺乏前瞻性的随机对照研究,可根据EGFR-TKI治疗后进展模式选择相应治疗策略。研究显示,NSCLC患者使用第三代EGFR-TKIs耐药后出现SCLC的组织学转化,标准的SCLC化疗对该类型患者有效,可使用SCLC治疗标准EP(依托泊苷+卡铂)化疗方案[15]。
EGFR-TKI的耐药与复发是临床关注的热点问题。明确耐药分子机制,在此基础上需进行精准检测明确耐药分子改变,根据耐药机制,有驱动基因可针对性使用相应的靶向治疗药物,未来联合治疗是方向。在靶向联合治疗、新型靶向药物的研发,以及免疫治疗的多重选择下,有望改善EGFR-TKI耐药困境,为患者带来更大的生存获益。相信很快会有更多敏感药物惠及更多的肺癌患者!
参考文献
往期相关内容推荐
关于圣美基因
珠海市圣美基因检测科技有限公司(以下简称“圣美基因”),是专业从事医学检测服务的高科技服务型企业(原“丽珠基因”)。圣美基因致力于肿瘤精准医学检测项目的开发和应用,立足liquidbiopsy液态活检、肺部结节良恶性鉴定和肿瘤免疫治疗检测等特色平台,拥有包括肿瘤液态活检和组织基因检测的30余项检测项目,同时整合国际领先技术,旨在建设和发展拥有国际领先水平的全国性特检连锁实验室。
微信扫一扫
关注该公众号





 粤公网安备 44040402000183号
粤公网安备 44040402000183号